Tabla Periodica De Bohr
Ejercicios 1- Escribir la configuración electrónica del estado basal del Arsénico Z33 y dibujar un diagrama de llenado de orbitales representando.
Tabla periodica de bohr. MY PRESENTATION SUBTITLE GOES HERE Modelos Atòmicos de la Estructrura Interna de la Materia Estructura Interna de la Materia Topic 2 Modelo Bohr Text Modelo de Bohr mantiene la estructura planetaria. Tabla periódica - Zmaczynski El sistema propuesto por E. El modelo de Bohr sería igual que el de Rutherford donde el electrón solo se mueve en unas órbitas circulares permitidas sin que exista emisión de.
Sin embargo pronto fue necesario modificar el modelo para que pudiera explicar los datos experimentales correspondientes a átomos más complejos. Describió el átomo de hidrógeno con un protón en el núcleo y girando a su alrededor un electrónEn este modelo los electrones giran en órbitas circulares alrededor del núcleo ocupando la órbita de menor energía posible o la órbita más cercana posible al núcleo. Modelo de la mecánica cuántica de.
De órbitas de Bohr a orbitales de Schrödinger 11008 LA TABLA PERIÓDICA 121 A este fenómeno se le conoce como principio de incertidumbre de Heisenberg. Para poder ver un objeto es necesario que. Ea - Eb h v h RM 1nb2 - 1na2 El Modelo Atómico de Bohr explica las insuficiencias del Modelo Atómico de Rutherford sobre la estabilidad de las órbitas del electrón y la existencia de espectros de emisión característicos.
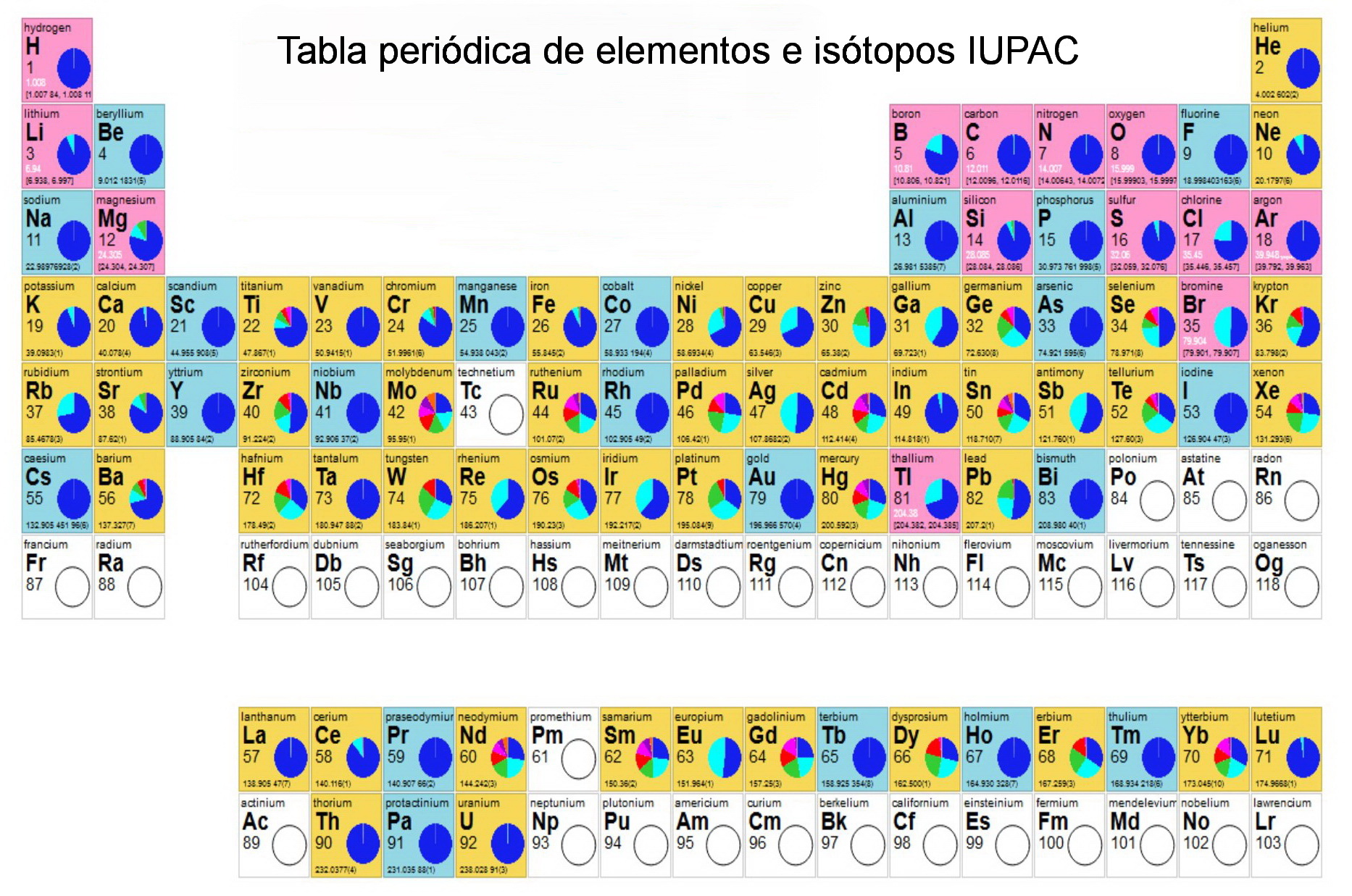
Zmaczynski en 1937 bautizado por él mismo como Sistema Periódico de los Elementos por Chancourtois-Mendeleiev-Werner-Bohr fue utilizado durante años en la Universidad de Minsk. Tabla periódica - Bohr. El nuevo modelo atómico vino junto con el desarrollo de la mecánica cuántica que el propio Bohr contribuyó a desarrollar.
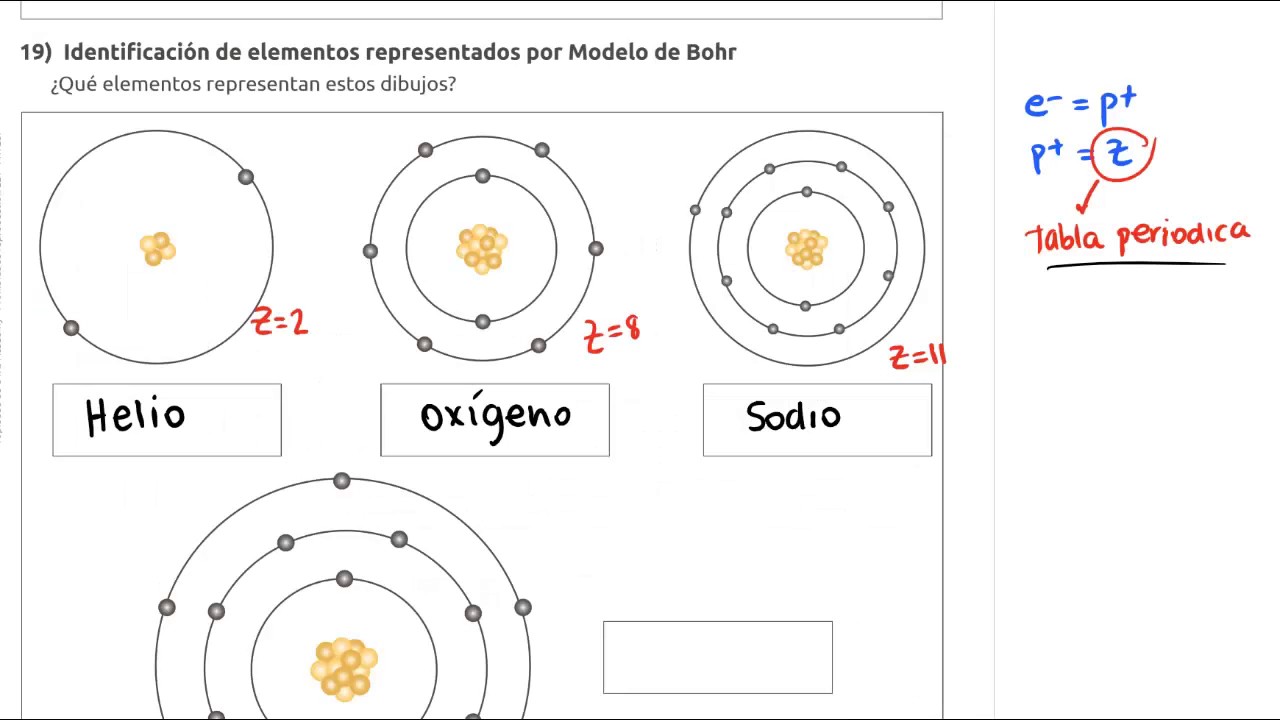
En el modelo atómico de Bohr de la estructura del átomo desarrollado por Niels Bohr en 1913 los electrones giran alrededor de un núcleo central. A partir de su interpretacion del modelo atomico bohr pudo estructurar detalladamente la tabla periodica de elementos que existia en su tiempo y afirmo que las propiedades quimicas y la capacidad de enlace de un elemento estaba relacionada con su carga de valenciaslos trabajos de bohr en la tabla periodica dieron desarrollaron un nuevo campo de la quimica. En 1913 Henry Moseley basándose en experimentos con rayos X determinó los números atómicos que permitieron una nueva organización estableciendo así la Ley Periódica actual que dice.
Explicaciónespero que te ayude. El modelo atómico de Bohr explicaba el átomo de hidrógeno. Divide los grupos en metagrupos y ortogrupos según sean períodos largos o cortos.
Esto puede ilustrarse como sigue. Química modelo de Bohr átomo electrón capa de electrones tabla periódica elemento químico estructura de Lewis png. Como las propiedade químicas de los elementos dependen en gran medida de la estructura electrónica aquellos elementos que pertenecen a un mismo.
Modelo atómico de Bohr 1914 3. La forma más usada y más conocida de la tabla periódica la llamada Tabla Periódica Larga o Tabla de Bohr o Tabla de Bohr y Sommerfeld Figura 7. Scuela olitécnica acional ormulario undamentos de uímica partícula rotón lectrón carga eléctrica ues ues masa kg 28 91x10 kg.
Para definir la posición de un electrón es necesario ver donde está. De todos estos el más estable es el bohrio-270 el cual tiene una vida de 61 segundos. Antecedentes de la tabla periódica actual.
El modelo de Bohr incorpora también la teoría del efecto fotoeléctrico de Einstein. Niels Bohr propuso un modelo atómico según el cual los electrones se agrupan alrededor del nucleo formando capas concéntricas de modo que cumplen unas condiciones determinadas. Las propiedades químicas de los elementos son función periódica de sus números atómicos lo que significa que cuando se ordenan los elementos por sus números atómicos en forma ascendente aparecen grupos de ellos con propiedades químicas similares y propiedades físicas que.
El orden de. Figure 0630 20. Y el bohrio-274 que tiene una vida media de 40 segundos.
Modelo de Bohr y la Tabla Periódica by Yaridelia Contreras Hernández. Los electrones giran en orbitas circulares fijas alrededor del núcleo. Clasificación de los elementos y propiedades periódicas John Newlands 1837-1898 Surrey-Inglaterra.
Triadas de Dobereimer. Por la esquina superior izquierda de la tabla y seguir por los renglones sucesivos. La tabla periódica de los elementos es una disposición de los elementos químicos en forma de tabla ordenados por su número atómico número de protones 2 por su configuración de electrones y sus propiedades químicasEste ordenamiento muestra tendencias periódicas como elementos con comportamiento similar en la misma columna.
En este modelo los electrones orbitan solo a determinadas distancias del núcleo dependiendo de su energía.